La pile à combustible : production d'énergie propre
Les piles à combustible mettent en jeu des réactions d'oxydoréduction où l'oxydant est le comburant et le réducteur le carburant. Plusieurs combustibles sont possibles mais la plus connue et la plus développée est la pile à hydrogène (H2). On utilise également l'acronyme PEMFC pour « proton exchange membrane fuel cells ».
Ces dispositifs sont
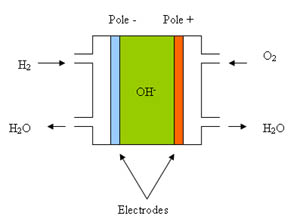
Pile à hydrogène
La pile est alimentée en dihydrogène (H2) et en oxygène (O2).
Dans le cas ou l'oxydoréduction est réalisée en milieu basique on a :
– au pôle positif de la pile (cathode), le comburant est dans ce cas l'oxygène est réduit suivant la réaction :
1/2 O2 + H2O + 2 e– <–> 2OH–
– au pole négatif, il y a oxydation de l'hydrogène selon la réaction :
2OH– + H2 <–> 2H2O + 2 e–
La réaction globale s'effectue donc selon la réaction :
1/2O2 + H2–> H2O
La pile à combustible à hydrogène produit donc de l'eau d'où son intérêt sur un plan écologique. La force électromotrice de la pile théorique est de 1,23V mais la tension est en pratique inférieure à 1 volt.
En pratique, l'apport d'oxygène n'est pas un frein, puisqu'il est présent dans l'air. Ce n'est le cas de l'hydrogène qu'il faut produire.
Le dihydrogène est produit par électrolyse de l'eau. Sur le principe, il n'y a pas de difficultés particulières mais cela s'avère très coûteux. Il faut en notamment produire de l'électricité pour réaliser l'électrolyse. Pour que le bilan environnemental soit positif, l'utilisation d'énergie fossile est à proscrire.
Au niveau des matériaux de la pile à combustible, certaines pièces sont chères avec une durée de vie faible. C'est le cas de la membrane ionique qui sépare les demi-cellules électrolytiques. Du platine, un métal précieux, est également utilisé comme catalyseur.
D'autres modèles de piles sont actuellement en développement : à méthanol, à oxyde solide…